Le tableau périodique des éléments chimiques
Le tableau actuel
Le tableau périodique des éléments chimiques, représente tous les éléments chimiques, ordonnés par numéro atomique croissant et organisés en fonction de leur configuration électronique, laquelle sous-tend leurs propriétés chimiques.
Plusieurs scientifiques ont contribué à l’élaboration du tableau périodique des éléments chimiques. Le tableau périodique moderne est basé sur la classification périodique des éléments chimiques proposée par le chimiste russe Dmitri Mendeleïev en 1869. Mendeleïev a organisé les éléments chimiques connus de l’époque en fonction de leurs propriétés chimiques, en les classant par ordre de masse atomique croissante. Il a même laissé des espaces vides pour les éléments chimiques qui n’avaient pas encore été découverts. Il a également prédit les propriétés de trois de ces éléments chimiques manquants, et a proposé des corrections pour les masses atomiques de plusieurs autres.
Le tableau simplifié
Au lycée, on étudie les éléments chimiques ayant un numéro atomique compris entre 1 et 18. Ils sont représentés dans le tableau périodique des éléments chimiques simplifié ci-dessous.
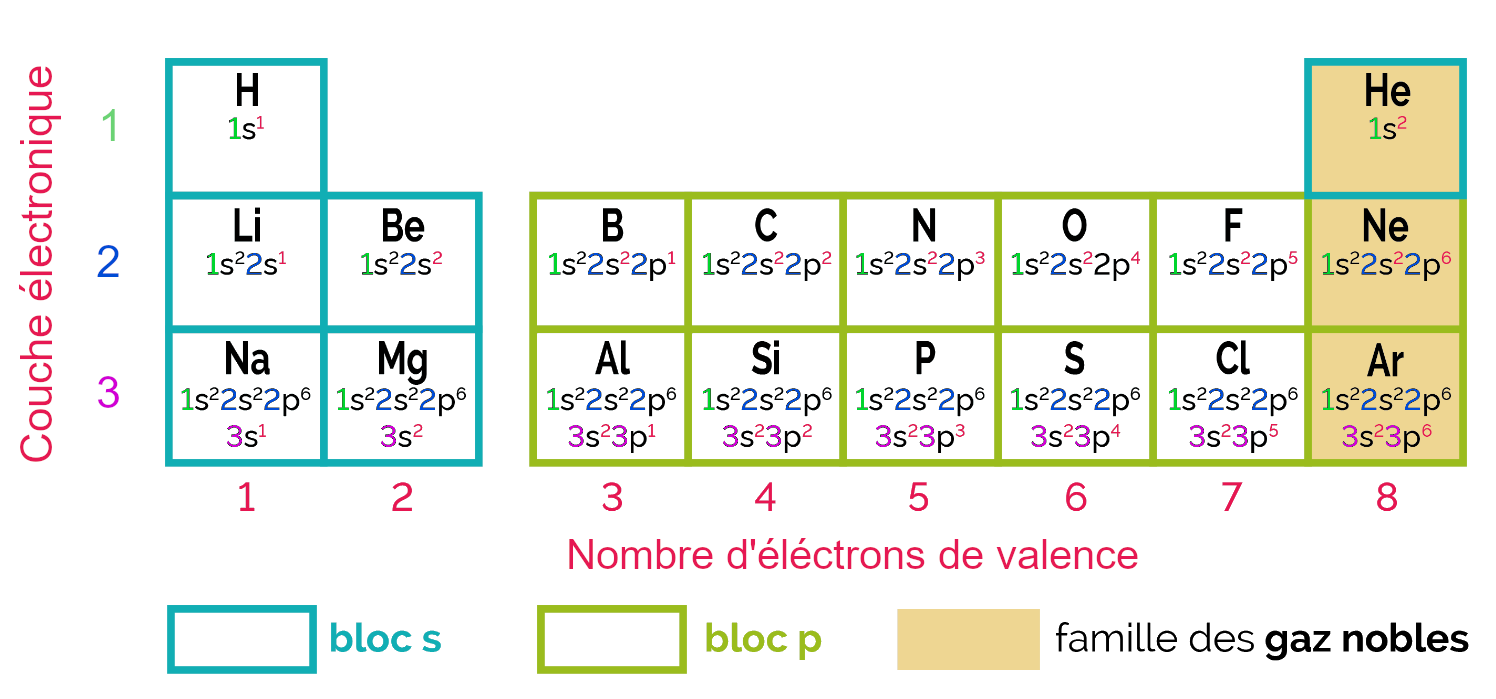
Les blocs s et p
Le tableau est partagé en deux blocs :
- le bloc s qui contient les éléments chimiques dont la dernière sous-couche électronique est une couche s ;
- le bloc p qui contient les éléments chimiques dont la dernière sous-couche électronique est une couche p.
Position d’un élément chimique
Il est possible de savoir positionner un élément chimique dans le tableau périodique des éléments chimiques à partir de sa configuration électronique et inversement, de déterminer la configuration électronique d’un élément chimique à partir de sa position dans le tableau périodique des éléments chimiques.
Méthode
Pour déterminer la position d’un élément chimique dans le tableau périodique des éléments chimiques d'après sa configuration électronique, il faut :
- identifier le nombre de couches électronique et la dernière couche électronique : c’est le numéro de la ligne ;
- identifier la dernière sous-couche électronique : c’est le bloc ;
- identifier le nombre d’électrons de valence : c’est le numéro de la colonne.
Pour déterminer la configuration électronique d’un élément chimique à partir de sa position dans le tableau périodique des éléments chimiques, il faut :
- identifier le numéro de la ligne : c’est le nombre de couches électroniques et le numéro de la dernière couche électronique ;
- identifier le bloc : c’est la dernière sous-couche électronique ;
- identifier le numéro de la colonne : c’est le nombre d’électrons de valence.
Exemple 1 : Soit un élément chimique dont la configuration électronique est
- Le nombre de couches électroniques est 2 et la dernière couche électronique est la couche 2 : l’élément chimique se trouve donc sur la ligne 2.
- La dernière sous-couche électronique est la sous-couche p : l’élément chimique se trouve donc dans le bloc p.
- Le nombre d’électrons de valence est 5 : l’élément chimique se trouve donc dans la colonne 5.
Exemple 2 : Soit un élément chimique dont la position dans le tableau périodique des éléments chimiques est la ligne 3, le bloc p et la colonne 4. Déterminer sa configuration électronique.
- ligne 3 : Le nombre de couches électroniques est 3 et la dernière couche électronique est la couche 3 : les deux premières couches électroniques sont donc remplies et la configuration électronique de l’élément chimique est donc
- bloc p : La dernière sous-couche électronique est la sous-couche p : la sous-couche
- colonne 4 : Le nombre d’électrons de valence est 4. Il y a déjà 2 électrons dans la sous-couche
La famille des gaz nobles
Les éléments chimiques de la famille des gaz nobles sont les éléments chimiques de la dernière colonne du tableau périodique des éléments chimiques. Ils ont tous une configuration électronique avec des couches électroniques remplies, saturées. Ils sont donc très peu réactifs.
Ainsi on remarque que l'Helium (