Méthodes chimiques
Les méthodes chimiques, notamment les titrages, sont basées sur des réactions chimiques qui permettent de déterminer la quantité de matière d’une espèce chimique dans un système. L’espèce chimique dont on souhaite déterminer la quantité de matière est donc consommée. Les méthodes chimiques sont des méthodes destructives.
Principe du titrage
La réaction support du titrage
Important
Au cours d’un dosage par titrage, une réaction chimique a lieu entre deux espèces chimiques :
- Une espèce chimique dont on souhaite déterminer la concentration : le réactif titré (A).
- Une espèce chimique de concentration connue : le réactif titrant (B).
Cette réaction est appelée réaction support du titrage. Elle doit être rapide, totale et unique.
Exemple : Le titrage de
L’équivalence du titrage
Lors d’un titrage, on introduit progressivement une solution contenant le réactif titrant B dans un volume
Important
À l’équivalence, la quantité de matière du réactif titré
Remarque
Avant l’équivalence, le réactif limitant est le réactif titrant ; après l’équivalence, le réactif limitant est le réactif titré. À l’équivalence les deux réactifs sont limitant.
Voici un exemple d’évolution des quantités de matière pour une réaction quelconque
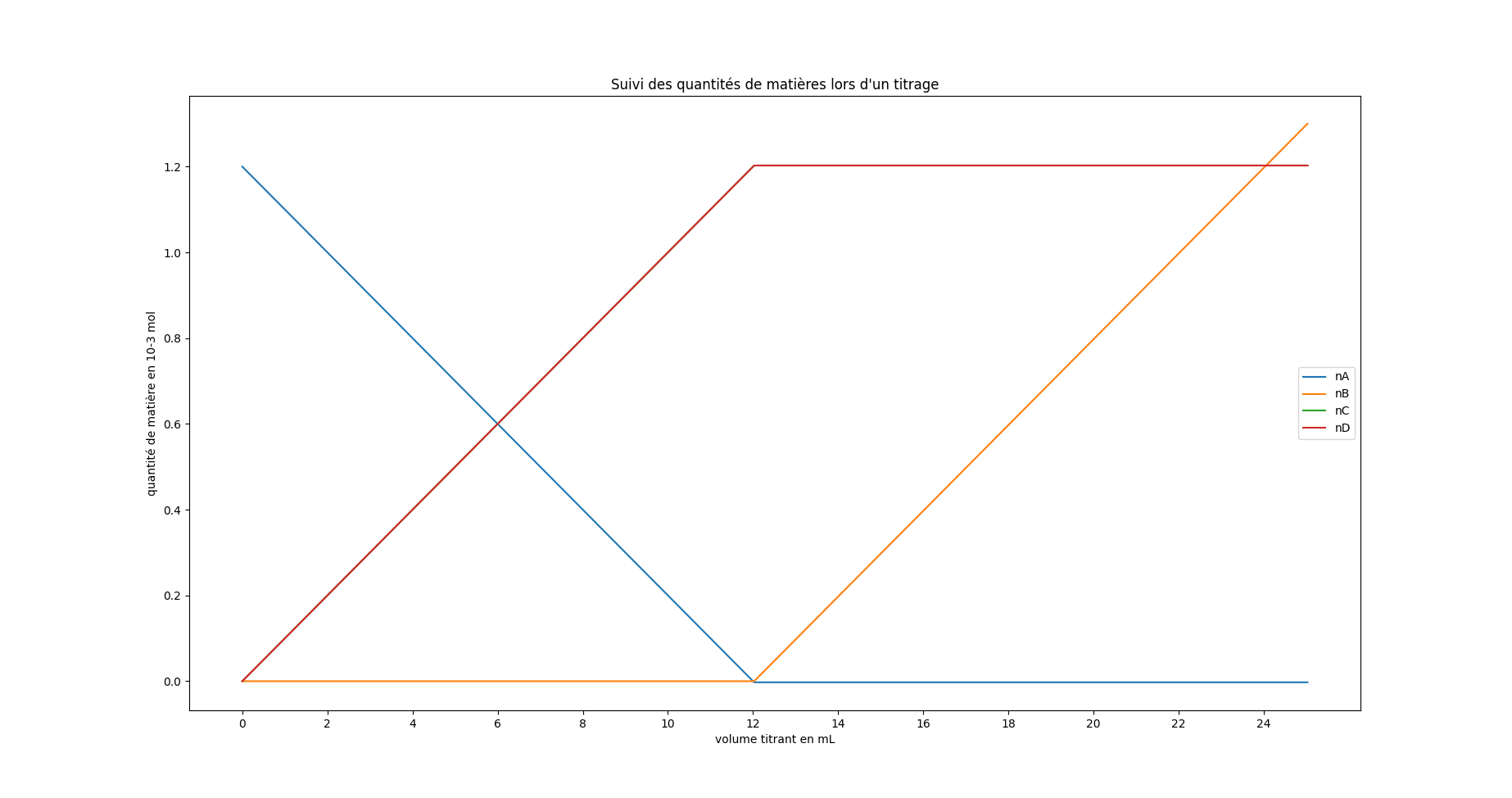
Si l’on peut repérer l’équivalence, on peut alors déterminer la quantité de matière initiale du réactif titré
Exercice : Soit la réaction support du titrage
- Déterminer, graphiquement, le volume de réactif titrant
- Déterminer, par le calcul, la quantité de matière
- Déterminer la concentration initiale
Afficher les réponse
On observe que les réactifs A et B sont tous les deux limitant pour
On calcule
Sur le graphique, on observe bien que
On calcule
Montage général
Le montage d’un titrage est le même pour tous les titrages.
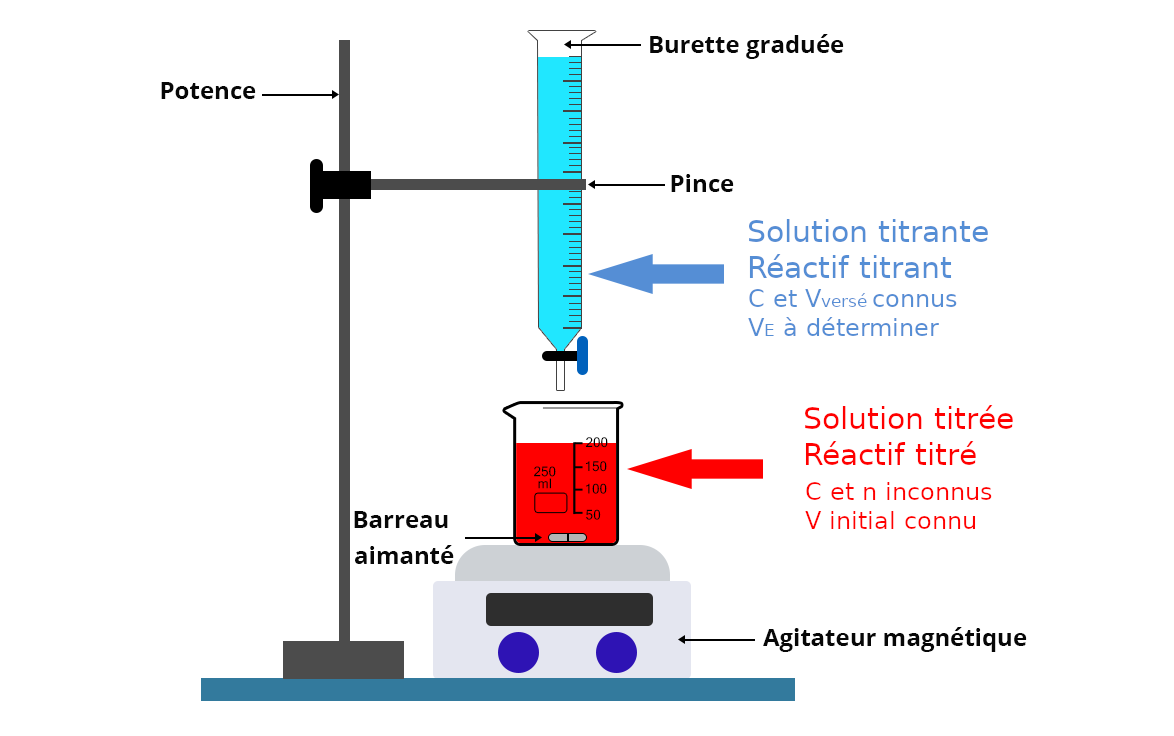
Un titrage par suivi permet d’exploiter d’exploiter l’évolution d’une grandeur physique au cours du titrage qui présente une brusque varation au passage par l’équivalence.
- On place un conductimètre dans le bécher contenant la solution titrée s’il s’agit d’un titrage conductimétrique.
- On place un pH-mètre dans le bécher contenant la solution titrée s’il s’agit d’un titrage pH-métrique.
- On ajoute un indicateur coloré dans la solution titrée s’il s’agit d’un titrage colorimétrique.
Titrage conductimétrique
Principe du titrage conductimétrique
Lors d’un titrage conductimétrique, on trace une courbe représentant la conductivité
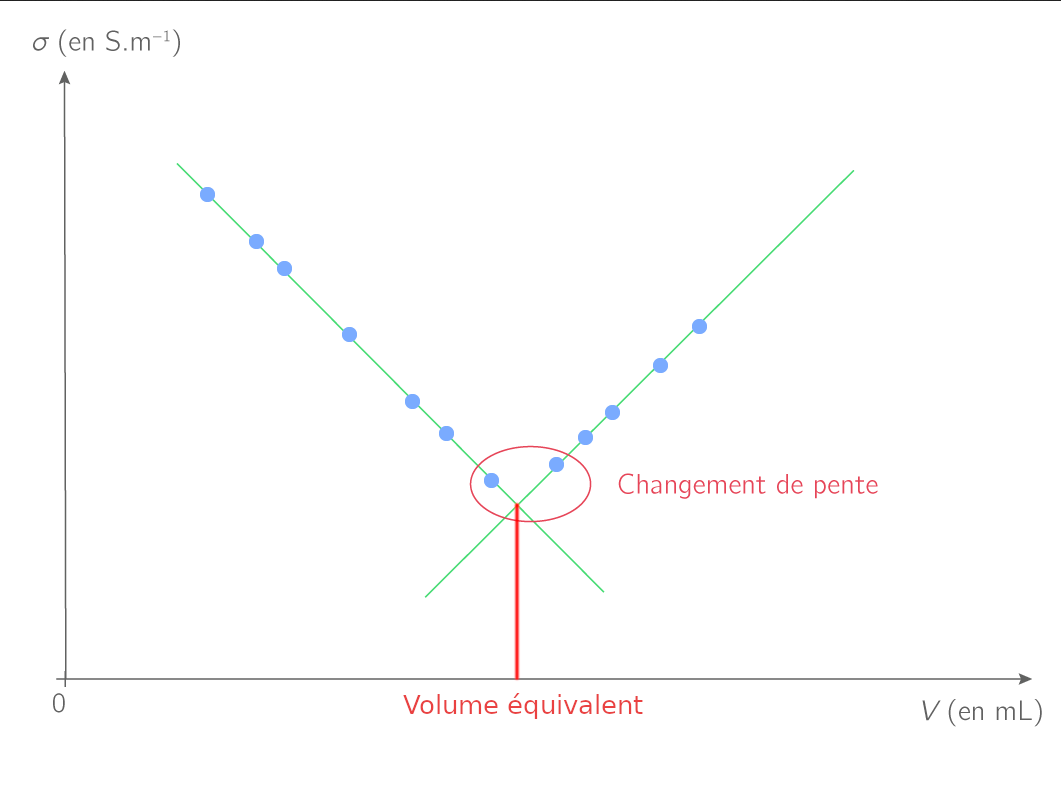
Exploitation de la courbe σ=f(V)
Le changement de pente peut s’expliquer en examinant les conductivités molaires ioniques des espèces chimiques en solution.
La valeur de la conductivité
| Ions | Conductivité molaire ionique ( |
|---|---|
| 35 | |
| 20 | |
| 5,0 | |
| 7,6 |
Titrage pH-métrique
Principe du titrage pH-métrique
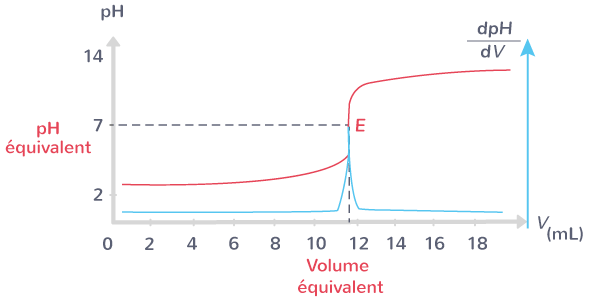
Lors d’un titrage pH-métrique, on trace une courbe représentant le
Exploitation de la courbe pH=f(V)
Pour déterminer le volume équivalent à partir de la courbe pH-métrique on peut utiliser :
- La méthode des tangentes: Tracer deux tangentes parallèles de part et d’autre du saut de pH, puis de tracer une troisième droite équidistante et parallèle aux deux premières. Le volume équivalent
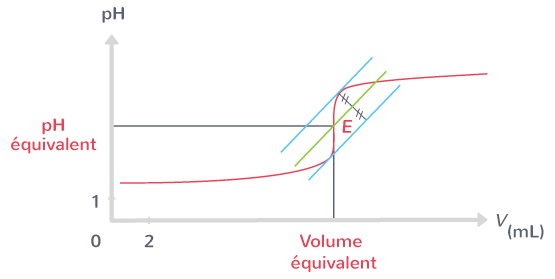
- La méthode de la dérivée: À l’aide d’un logiciel, la courbe dérivée de la courbe de titrage
Titrage colorimétrique
Principe du titrage colorimétrique
Lors d’un titrage colorimétrique, l’équivalence est repérée grâce à un changement de couleur du milieu réactionnel. Cela peut être du à un réactif coloré qui disparaît ou un produit coloré qui apparait au cours de la réaction support du titrage. Si ce n’est pas le cas, on peut également ajouter espèce chimique appelée indicateur colorée de fin de réaction. Dans le cas d’une réaction support du titrage acide-base, on utilise un indicateur coloré acide-base.
Choix de l’indicateur coloré acide-base
Un indicateur coloré acide-base est un couple acide-base dont la forme acide et la forme basique n’ont pas la même couleur.
Pour choisir convenablement un indicateur coloré acide-base pour un titrage colorimétrique il faut que le pH à l’équivalence soit contenu dans la zone de virage de l’indicateur coloré.
Voici des exemples de quelques indicateurs colorés usuels :
| Indicateur coloré | Couleur de la forme acide | Zone de virage | Couleur de la forme basique |
|---|---|---|---|
| Hélianthine | Rouge | 2,4-4,4 | Jaune |
| Bleu de bromothymol (BBT) | Jaune | 6,0-7,6 | Bleu |
| Phénolphtaléine | Incolore | 8,2-9,9 | Rose |