Force des acides et des bases
Constante d’acidité
Un acide
Si cette transformation est totale, alors cet acide est dit fort. Si cette transformation est un équilibre, alors cet acide est dit faible.
Si cette transformation est un équilibre, on peut alors définir une constante d’équilibre
Important
Un couple acide faible/base faible
Pour le couple de l’eau
Pour une température donnée, le produit ionique de l’eau a la même valeur pour toutes les solutions aqueuses. À 25 °C,
Attention aux confusions
Soit la transformation d'équation de réaction suivante
La constante d’équilibre
La constante d’acidité du couple
La constante d’acidité du couple
Échelle des pKA
Le pKA d’un couple acide-base est défini par :
on en déduit :
Plus le pKA du couple est grand (ou plus la constante d’acidité est petite), moins l’acide se dissocie dans l’eau.
En effet, plus
On peut alors définir une échelle des pkA, permettant de comparer la force des acides et des bases.
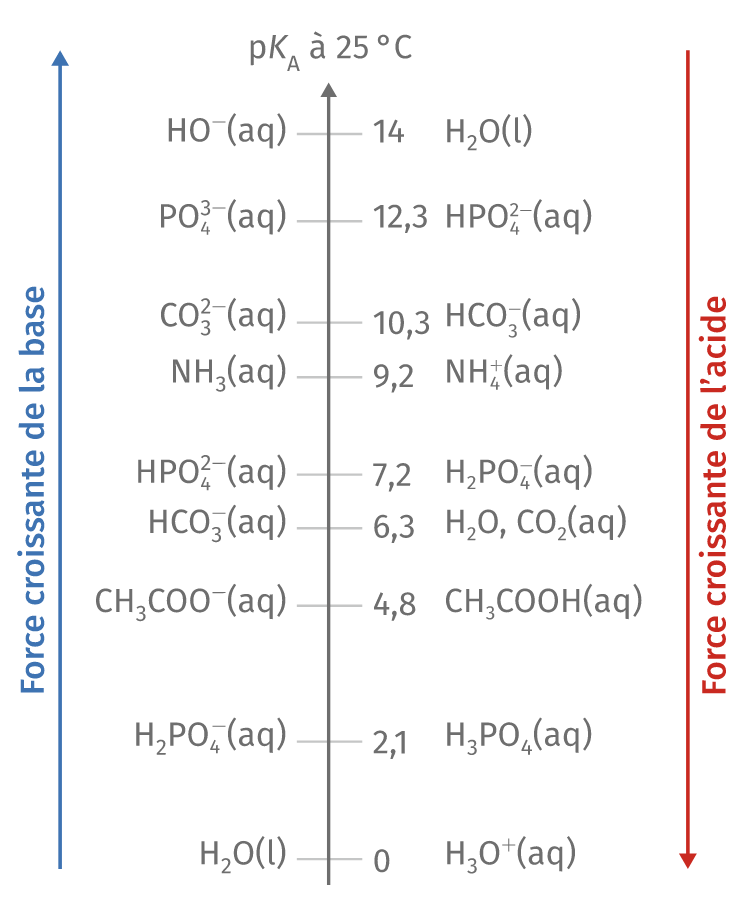
Diagramme de prédominance
A partir de la relation de la constante d’acidité, on peut écrire une relation liant le pH et le pkA d’un couple acide base.
Une autre méthode :
Remarque
Il est possible de passer de la relation
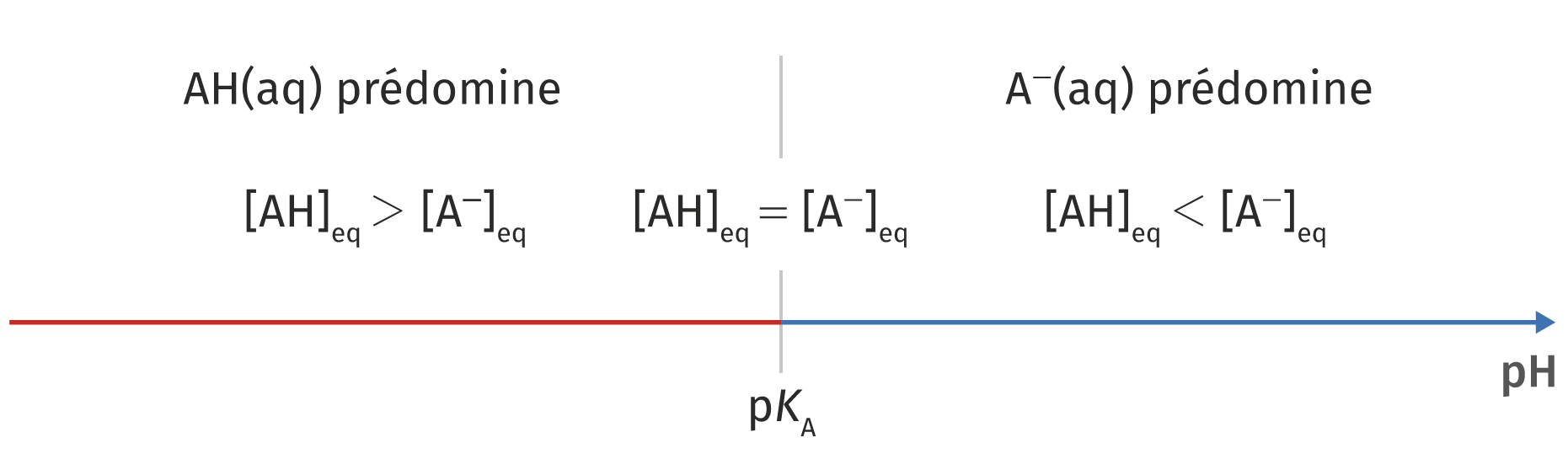
On remarque alors que :
- Si
- Si
- Si
On résume ces informations par un diagramme de prédominance :
Attention
Il est important de noter que l’acide peut prédominer en pH basique (>7) et que la base peut prédominer à pH acide (<7). En effet cela dépend du pkA.
Par exemple pour le couple
En réalité il est peu approprié de parler de "prédominance" lorsque le pH est compris entre
Lorsque que l’acide et la base d’un couple sont de couleurs différentes, la solution n’est alors ni de la couleur de l’acide ni de la couleur de la base; c’est un mélange des deux.
C’est le cas des indicateurs colorés acide base. Cette zone où le pH est compris entre
Dans le cadre d’un titrage colorimétrique acide base, il faut choisir un indicateur coloré acide base dont la zone de virage est aux alentour du pH à l’équivalence. En d’autres termes, le pkA du couple acide base
Les espèces amphotères
Les espèces chimiques amphotères appartiennent à plusieurs couples acide base. C’est le cas de l’eau par exemple ou encore des acides α-aminé.
Pour les acides α-aminés, le groupe carboxyle possède des propriétés acides et le groupe amine des propriétés basiques. Il est alors possible de définir deux pkA. Ainsi, un acide α-aminé peut exister sous trois formes et son diagramme de prédominance sera :
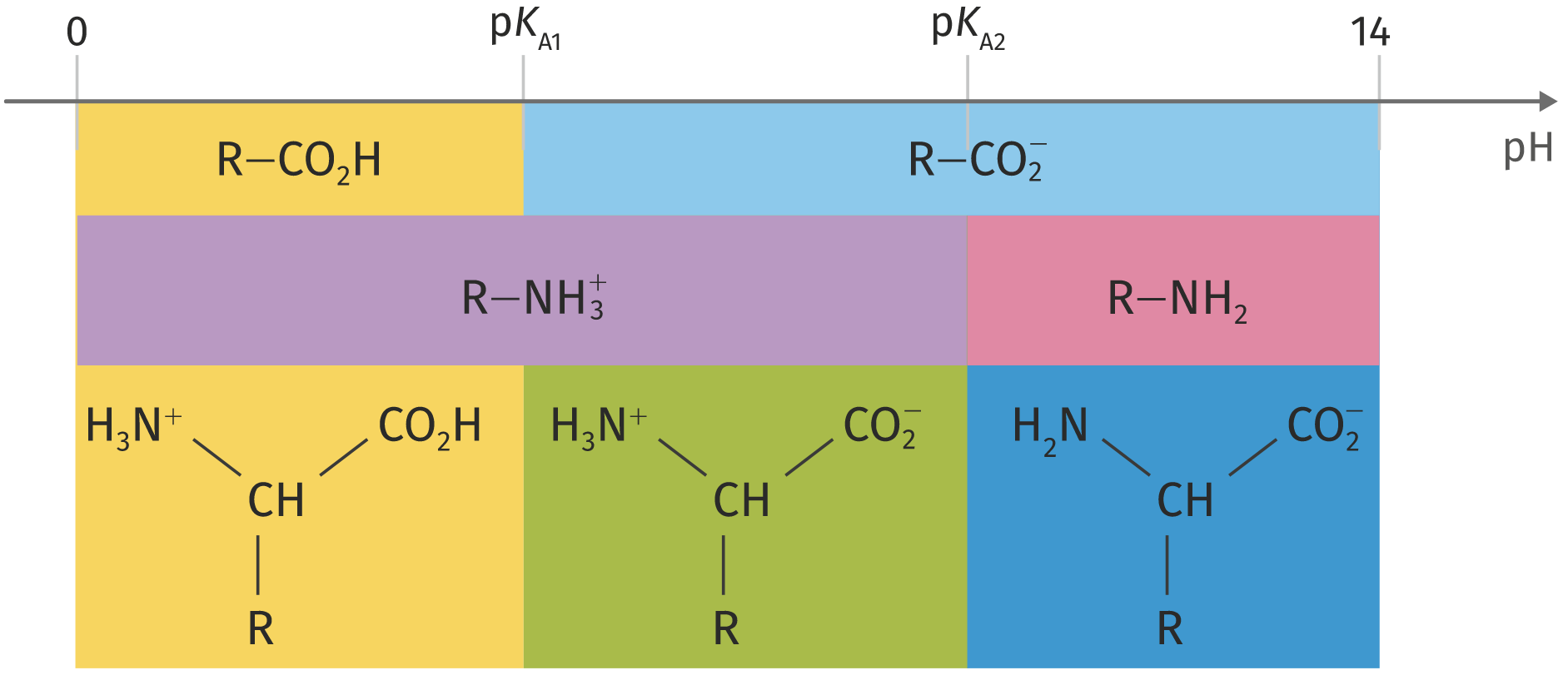
Le raisonnement est identique pour toutes les espèces chimiques amphotères, comme l’eau par exemple.