Méthodes physiques
Les dosages par étalonnage
Principe
Un dosage par étalonnage consiste à déterminer la concentration
On peut alors tracer une courbe d’étalonnage à partir des mesures, de la grandeur physique mesurée en fonction de la concentration.
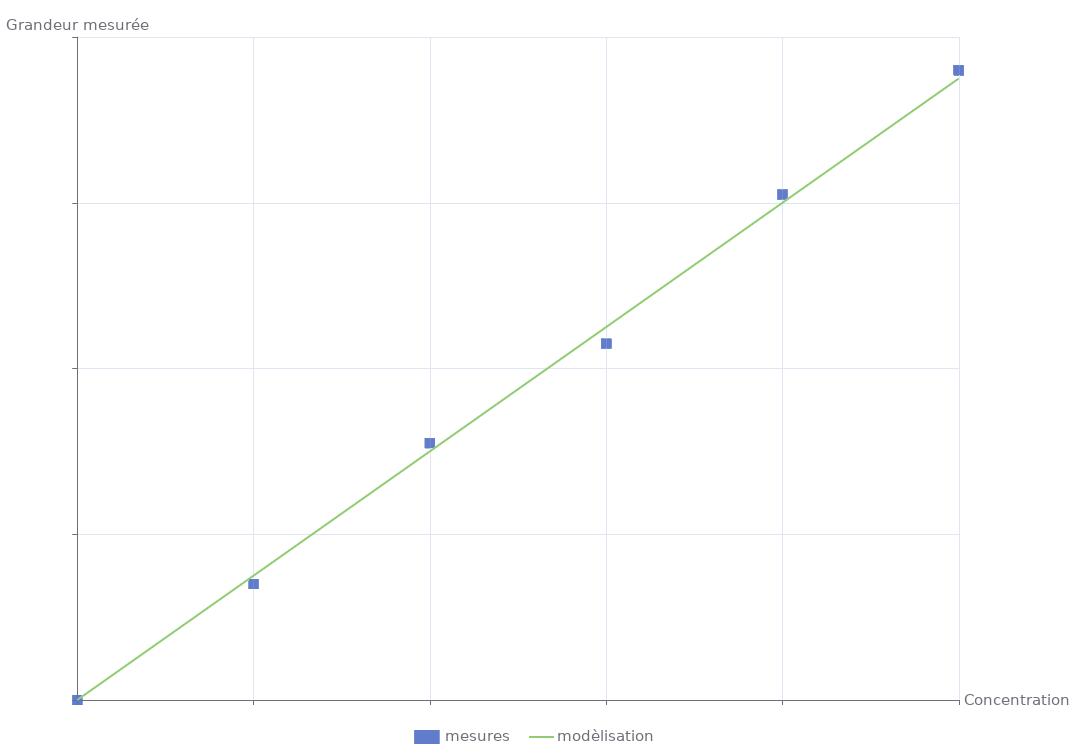
Pour déterminer la concentration
- on mesurer la grandeur physique pour la solution de concentration
- on détermine la concentration
- graphiquement en lisant directement la courbe d’étalonnage
- par le calcul à partir de l’équation de la courbe d’étalonnage
Il n’y a pas de réaction chimique lors d’un dosage par étalonnage. Ainsi l’espèce chimique
Dosage par spectrophotométrie UV-Visible
Principe du dosage
Lorsqu’une lumière UV-Visible traverse une solution, une partie de la lumière est absorbée par les espèces chimiques en solution. L’absorbance notée
Important
Dans un spectrophotomètre, la largeur de la cuve et la longueur d’onde étant fixées, on peut écrire pour une espèce chimique donnée de concentration
Attention
Pour avoir une meilleure précision sur le dosage on doit régler la longueur d’onde du spectrophotomètre sur la longueur d’onde d’absorption maximale de l’espèce chimique analysée.
Courbe d’étalonnage en spectrophotométrie
- Courbe d’étalonnage :
- Le coefficient directeur de la droite correspond au coefficient de proportionnalité
Lien entre couleur perçue et longueurs d’onde absorbées
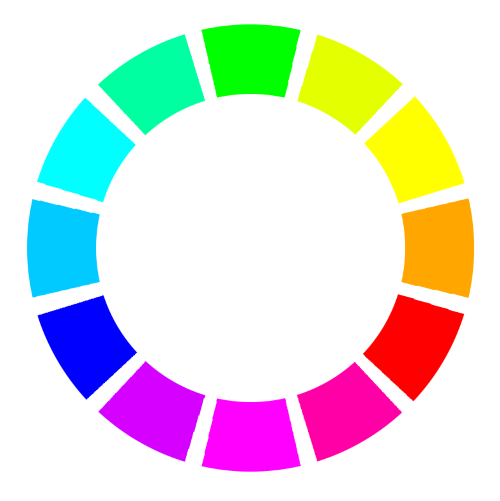
Une espèce incolore n’absorbe aucune radiation du spectre visible.
Lorsqu’une espèce chimique n’absorbe que dans un seul domaine de longueurs d’onde du visible, sa couleur est la couleur complémentaire de celle des radiations absorbées.
Exemple : les ions cuivre (II) absorbent dans le
Lorsqu’une espèce chimique absorbe dans plusieurs domaines de longueurs d’onde, sa couleur résulte de la synthèse additive des couleurs complémentaires des radiations absorbées.
Exemple : les ions chrome (III) qui absorbent dans le
Dosage par conductimétrie
La conductivité notée
Rappel
en solution, ce sont les ions qui conduisent le courant électrique ; seuls les ions (particules chargées) ont une influence sur la valeur de la conductivité de la solution.
Important
La loi de Kohlrausch énonce que dans une solution diluée, la conductivité électrique
La conductivité totale
Attention
Les unités peuvent être source d’erreur en conductivité. En effet, les volumes sont souvent exprimés en
On peut retenir :
Important
La conductivité d’une solution ne contenant qu’un seul soluté ionique
Cela permet de faire un dosage par étalonnage d’une solution contenant ce seul soluté.
Exemple : Soit une solution de
On peut alors écrire :
Courbe d’étalonnage en conductimétrie
- Courbe d’étalonnage :
- Le coefficient directeur de la droite correspond au coefficient de proportionnalité
Spectroscopie Infrarouge (IR)
Les composés organiques absorbent des radiations dans le domaine de l’UV-visible, mais aussi dans le domaine de l’infrarouge IR. L’absorption suit encore la loi de Beer-Lambert.
Présentation d’un spectre IR
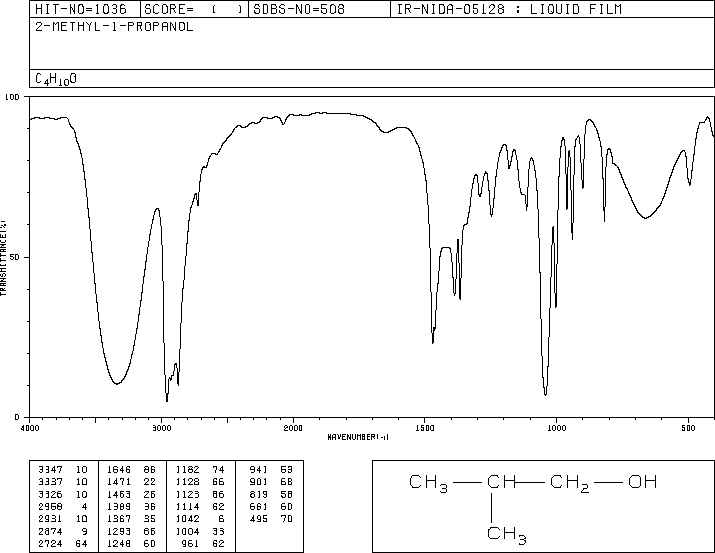
En Ordonnées : transmittance
En Abscisses : nombre d’ondes
Types de vibration
Les vibrations des liaisons d’une molécule sont à l’origine de son spectre infrarouge (IR). Ainsi un spectre infrarouge renseigne sur la nature des liaisons présentes dans une molécule et sur ses groupes caractéristiques.
Bandes d’absorption caractéristiques
Les bandes d’absorption associées à chacune des liaisons rencontrées correspondent à un domaine de nombre d’ondes σ. Pour les consulter et s’entrainer à identifier des molécules, vous pouvez utiliser le site http://chimie.ostralo.net/spectreIR/.