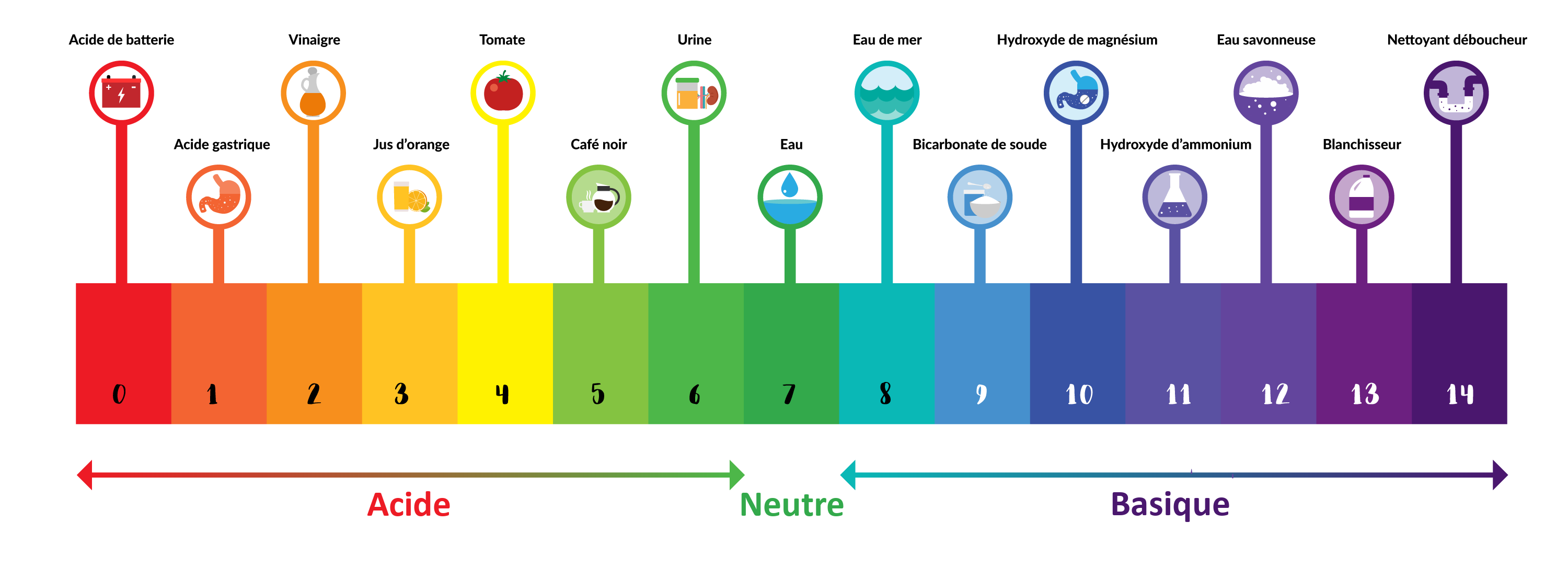
Le pH en solution aqueuse
Toutes les espèces chimiques acides en solution aqueuse réagissent totalement ou en partie avec l’eau. En effet, en solution aqueuse, l’eau est l’espèce chimique majoritaire et est une espèce amphotère, à la fois acide et base. Ainsi pour acide quelconque
La mesure de la concentration molaire en ions oxonium
Définition du pH
Le pH est une grandeur sans unité, comprise entre 1 et 14, liée à la concentration molaire en ions oxonium
Important
Le pH d’une solution aqueuse est défini par la relation :
avec
On en déduit :
INFO
Le concentration standard
Par souci de simplification, on calculera généralement :
On en déduit :
- Le pH d’une solution est d’autant plus faible, est donc d’autant plus acide, que la concentration en ion oxonium
- Le pH d’une solution est d’autant plus élevé, est donc d’autant plus basique, que la concentration en ion oxonium
Application :
- On mesure
- Le pH d’une solution aqueuse est de 9,5. Quelle est la concentration en ions
Afficher les réponses
- Le pH est égal à
- La concentration en ions
Vous pouvez observer les quantités d’ion oxonium
Mesure du pH
Le pH d’une solution peut se mesurer :
- À l’aide du papier pH, l’incertitude de la mesure est de l’ordre d’une unité
- À l’aide d’un pH-mètre étalonné, l’incertitude de la mesure est de l’ordre de 0,1 unité
La mesure du pH permet de classer les solutions en 3 catégories :
- Acide : pH < 7
- Neutre : pH = 7
- Basique : pH > 7